
新闻中心
欢迎您随时来电咨询
400-0532025
电子邮箱
info@microdetection.cn
发布时间:2016-03-20 19:43:32 来源:易贸诊断界 点击量:次
2016年1月21日至22日在京召开的全国医疗器械监督管理工作会议上,总局部署了2016年医疗器械监督管理重点工作,其中提到今年将适时启动医疗器械临床试验数据核查…
2016年2月27日,总局发布了《关于对日本富士瑞必欧株式会社的乙型肝炎病毒核心相关抗原(HBcrAg)检测试剂盒不予注册的公告》(2016年第44号)。宣布此次医疗器械临床试验数据核查中首个因临床试验数据存在真实性问题而不予注册的医疗器械产品,并在通告中详细阐述了该产品临床试验数据存在的5个主要问题。
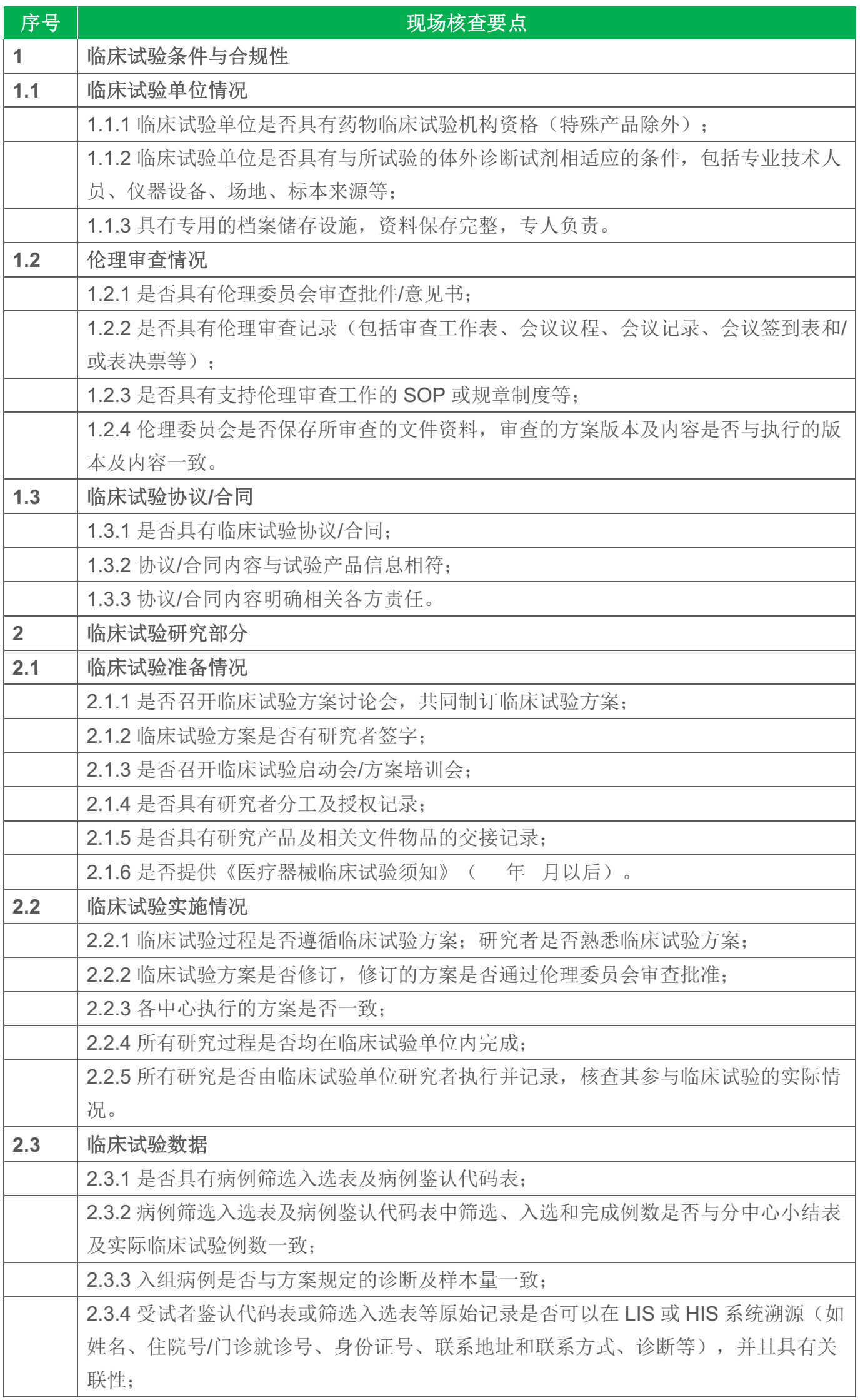
2015年3月9日,北京食品药品监督管理局发布《关于征求体外诊断试剂临床试验现场核查要点意见的通知》,旨在加强体外诊断试剂临床试验管理,保障体外诊断试剂临床试验现场核查质量。《征求意见稿》将体外诊断试剂临床试验分为免于临床试验(51项核查要点)和需知情同意(56项核查要点)2类,并分别列出了51和56项针对性的现场核查要点,意见征集期截止至2016年3月21日。
《体外诊断试剂临床试验现场核查要点(征求意见稿)》全文
一、免知情同意临床试验




背景链接
去年号称“史上最严”的药物临床试验数据真实性核查可以看到2个清晰的阶段:申请人及临床机构自查阶段;监管机关核查阶段。
申请人自查历时1个月,自7月22日至8月28日。在获得了申请人自查的初步数据后,于9月24日要求临床试验机构开展自查。
2015年11月10日,在启动真实性核查后的第4个月,总局发布《关于药物临床试验数据现场核查要点的公告》,旨在进一步规范药物临床试验数据现场核查。
2016年1月20日,仅5个月的时间,申请人主动撤回或由总局按撤回注册申请处理的药品注册申请累计达到1150个,占自查品种总数的71%
从反应速度上看,此次医疗器械临床试验真实性核查似乎来得更凶猛~